l'Atome de Sodium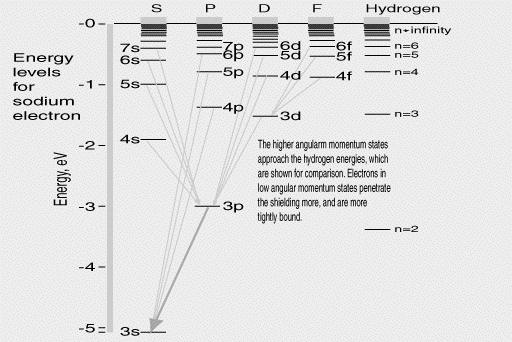
Après sa première réussite avec son modèle d'atome, Bohr essaya de continuer au-delà de l'hydrogène, en collaboration avec un théoricien plus âgé, l'Allemand Arnold Sommerfeld. Ils avaient remarqué que les atomes comme le sodium avaient à peu prés le même comportement que l'hydrogène, puisqu'un seul électron était impliqué dans leurs activités chimiques. Cela voulait dire qu'un simple électron actif orbitait en périphérie du noyau, alors que le reste des électrons se regroupait plus près de lui. L'atome de sodium est en lui-même électriquement neutre. En notant par la lettre e : la charge de l'électron: s'il y a11 électrons d'une charge totale –11e, ce que les données sous-entendaient, alors le noyau doit équilibrer l'atome par une charge +11e. Si 10 des électrons se regroupent symétriquement autour du noyau, il en résulte que la charge –10e est précisément annulée par les effets des 10e de la charge électrique du noyau, l'électron externe isolé est donc soumis à une force électrique de +e située juste au centre, la même chose que l'électron dans l'atome d'hydrogène ! En fait, les niveaux d'énergie observés ( A droite du schéma ci-dessus) sont comparables à ceux de l'hydrogène (également montré, en comparaison), bien que chaque niveau soit maintenant occupé par des ensembles complets. Bohr et Sommerfeld pensaient que ces orbites se présentaient avec une ellipticité différente, et donc différents moments angulaires. En principe les niveaux d'énergies auraient dû être décalés -- mais personne ne pouvait mettre en évidence ces décalages. Les lignes reliant les niveaux d'énergie représentent les transitions "permises", à partir desquelles un photon peut être émis. Bien sur, seules certaines des nombreuses transitions possibles se produisent dans la nature. Magnétisme et rotation( spin) d'électronLe moment angulaire d'une charge électrique en rotation est également associé au magnétisme : un électron satellisé autour d'un noyau peut être comparé (en moyenne) au passage d'un courant électrique suivant son orbite, créant un champ magnétique analogue à celui que créerait un petit aimant au centre, perpendiculaire au plan de l'orbite. Le moment angulaire du mouvement et la force de cet aimant sont proportionnels. Si l'atome est placé dans un champ magnétique, l'interaction peut changer le moment angulaire et donc le niveau énergétique -- vers le haut ou vers le bas, selon la direction de l' "aimant." Il en résulte que les niveaux d'énergie peuvent se scinder en plusieurs sous-couches bien séparées. Un "saut quantique" vers un niveau plus bas peut atteindre l'un de ces niveaux finement séparés, d'où l'apparition d'un "multiplet" de plusieurs lignes étroitement séparées à la place d'une simple ligne spectrale de fréquence fixe. Cela avait été observé pour de nombreux atomes, mais cependant la théorie ne concordait pas vraiment. En 1925, deux jeunes physiciens, George Uhlenbeck et Sam Goudsmit pensèrent avoir trouver pourquoi: ils proposèrent que l'électron était sans doute lui-même en rotation sphérique, avec son propre moment angulaire de "rotation" et son propre magnétisme. On pouvait comprendre dès lors ce dédoublement en combinant cette rotation avec le moment angulaire orbital de façon à ce que les deux vecteurs interférent l'un avec l'autre et en impliquant quelques règles quantiques expérimentalement calculées. Les règles régissant les liaisons des différents niveaux d'énergie pouvaient être établies et ce qui ne le pouvait pas avaient été également calculé. Le magnétisme de l'électron en rotation s'est avéré être exactement le double de ce qui avait été prévu, ce qui fut ultérieurement expliqué par Dirac, en utilisant la relativité. C'était un arrangement qualitatif, mais dont le modèle était conforme aux données générales. La Table PériodiqueAvec les éléments chimiques comprenant de nombreux électrons (comme le sodium), on peut prévoir que les électrons extérieurs sautent d'un niveau à l'autre. On pensait aussi que les électrons situés plus profondément, plus près du noyau, sont cependant sur des niveaux bien définis. La classification de ces éléments par ordre du poids de leurs atomes (obtenus à partir de leur densité à l'état gazeux ou d'autres procédés) a mis en évidence deux caractéristiques : Un, chacun présente un électron de plus que celui le précédant (cela a aussi été prouvé par les rayons X ), et deux, quelques modèles semblent se répéter, à plusieurs reprises.Par exemple, lithium, sodium, potassiumou également rubidium et cesium--- se comportent de la même façon du point de vue chimique et correspondent à un unique électron actif. Leurs autres électrons forment un ensemble sphérique serré près du noyau. Ces modèles répétitifs (en réalité peu nombreux) ont été pour la première fois mis en évidence par le chimiste russe Mendeleev ("Mendeleyev"), au 19ème siècle et il les avait utilisés pour prévoir l'existence de quelques éléments non encore découverts. Les électrons serrés près du "cÏur" central du lithium, du sodium, du potassium etc. semblaient présenter des structures tout à fait stables. Les éléments immédiatement avant eux sur la liste -- hélium, néon et argon -- étaient "les gaz rares" qui résistaient à toutes les combinaisons chimiques, ce qui suggérait donc que leurs électrons étaient tous rassemblés près du noyau, avec une liaison si stable qu'aucun autre atome ne pouvait les " casser ". Comment déterminer le nombre d'électrons dans ce "cÏur"--"-- et donc, le nombre d'éléments qu'il faut pour passer à une nouvelle "période" ? Le lithium étant le 3ème élément -- son " cÏur "possède donc 2 électrons. Le Sodium est le11ème - ce qui signifie qu'il y a 10 électrons de sodium en son cÏur, 8 de plus que le lithium, probablement une"deuxième couche" par rapport à celle du lithium (et ainsi de suite). De ce fait l'arrangement des niveaux énergétiques fut connu à partir des spectres, chacun avec un certain nombre d'états "permis" de moment cinétique, et l'idée était qu'ils formaient des "coques" de niveaux énergétiques autorisés a été parfaitement intégrée . Ce schéma fonctionnait en effet, mais seulement après que Pauli ait suggéré que chaque niveau s'adapte exactement à deux électrons de rotations opposées. Pour les éléments les plus lourds, les coquilles sont parfois dans un ordre différent que celui prévu (quelque "extérieurs" avant les "intérieurs"), mais ici aussi le modèle était efficace. Mais seulement le modèle ! Il avait sans doute été possible de classifier les niveaux énergétiques dans l'ordre, mais pas de prévoir leurs valeurs. Ni de connaître l'intensité des lignes de champ - pour un atome situé au niveau énergétique"A", quelles probabilités a-il de sauter en "B" ou en "C ?". Pourquoi par exemple les transitions dont résulte la double ligne jaune du sodium sont-elles si répandues qu'elles prédominent sur toutes les autres émissions de cet atome ? Et comme l'atome semblait ressembler à un système planétaire miniature, pourquoi les photons sont-il émis à des fréquences apparemment indépendantes de la période orbitale calculée pour de tels mouvements planétaires ? Et pourquoi ces règles arbitraires au sujet des moments angulaires ? La théorie de Bohr-Sommerfeld apparaissait donner plein de conseils, mais aucune réponse précise. . |