Invarianti adiabatici
Le leggi della fisica -- quelle fondamentali e quelle da esse derivate -- normalmente offrono degli enunciati precisi e quantitativi, come per esempio F=ma, E=mc2, E= hν. Molto raramente si incontra una legge secondo cui qualcosa è vero approssimativamente, ma non del tutto (anche se l'approssimazione può essere molto buona), per esempio, che sia valida per un tempo lungo ma non per tutta l'eternità. L'invarianza adiabatica è qualcosa di questo genere.
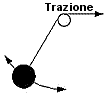
Immaginiamo un pendolo formato da un peso legato a una cordicella, che oscilla avanti e indietro sotto l'influenza della gravità. In ogni oscillazione, quando il peso scende nel punto più basso del suo percorso, esso guadagna energia cinetica, poi, quando ha superato quel punto, rallenta di nuovo, fino a fermarsi brevemente nel punto più alto dell'oscillazione. In assenza di attrito dell'aria, ci si aspetta che l'energia totale E (cinetica + potenziale) rimanga invariata, e che la frequenza ν e il periodo T=1/ν rimangano anch'essi costanti.
Se la cordicella passa per una puleggia (ved. figura) e si comincia a tirarla lentamente, la lunghezza del pendolo gradualmente diminuirà e, poiché un pendolo più corto ha una frequenza ν più alta e un periodo T più corto, ci si aspetta che anche queste quantità cambino. Però anche l'energia E aumenta, poiché si è compiuto un ulteriore lavoro contro la forza che tira la cordicella, per cui l'oscillazione acquista energia. Supponiamo che la corda sia tirata fino a che la sua lunghezza sia ridotta di una certa frazione -- diciamo della metà. Si può dimostrare che la variazione del rapporto E/ν può essere fatta piccola a piacere rendendo il processo di trazione abbastanza lento.
Questo rapporto non è una vera costante del moto o "invariante" (come l'energia di un pendolo imperturbato), ma di tipo approssimativo -- un "invariante adiabatico". La poca costanza può essere attribuita al fatto che la tensione della cordicella ad ogni oscillazione non varia in modo simmetrico -- si aggiunge una piccola asimmetria per il fatto che la cordicella viene costantemente accorciata però, rallentando la trazione, si riduce molto la asimmetria e i suoi effetti accumulati.
Notiamo qui che l'invariante adiabatico E/ν ha le stesse dimensioni di joule-sec (cioè la stessa combinazione di quantità misurabili) della elusiva costante di Planck h.
Gli invarianti adiabatici si ritrovano in tutti i tipi di moto periodico, compreso il moto kepleriano, che è stato preso come modello per il moto dell'elettrone attorno al nucleo. Alcuni fisici, in particolare Paul Ehrenfest, ipotizzarono che forse le orbite degli elettroni erano stabili quando l'invariante adiabatico I del loro moto corrispondeva ad h volte un certo numero intero. Per le orbite circolari in un atomo, esisteva soltanto un invariante adiabatico I, e consentendogli di assumere soltanto i valori I=nh con n=1,2,3... si ottenevano orbite con energie che si accordavano esattamente con lo spettro dell'idrogeno di Balmer.
Alla fine risultò che la quantizzazione del momento angolare, piuttosto che quella di I, consentiva una migliore comprensione qualitativa degli atomi con più di un elettrone. Tutto questo viene discusso nella sezione successiva.
Gli invarianti adiabatici attrassero di nuovo l'attenzione negli anni '50 del 1900, nello studio del moto degli ioni e degli elettroni nel plasma rarefatto. Un plasma è un gas abbastanza caldo da contenere un'apprezzabile frazione di elettroni e ioni isolati e, se è abbastanza rarefatto -- come, per esempio, il plasma nella "magnetosfera" che circonda la Terra --, queste particelle si possono muovere indipendentemente per lungo tempo prima di ricombinarsi. In presenza di un campo magnetico abbastanza intenso, esse tendono a girare a spirale lungo le linee del campo magnetico, e questo è un moto periodico con i suoi specifici invarianti adiabatici (in effetti, esistono varie periodicità e invarianti). La conservazione di questi invarianti è risultata essenziale per intrappolare le particelle nel campo magnetico della Terra e di altri pianeti, e anche per molti altri fenomeni del plasma sia nello spazio che in laboratorio. Tuttavia questa applicazione degli invarianti era parte della meccanica newtoniana ("classica"), e non comportava la costante di Planck h ma descriveva i fenomeni su una scala molto maggiore delle dimensioni atomiche. Per approfondire questi temi di ricerca, ved. la trattazione "Esplorazione della magnetosfera terrestre", da cui sono tratti i file precedentemente citati.