El Átomo de Sodio.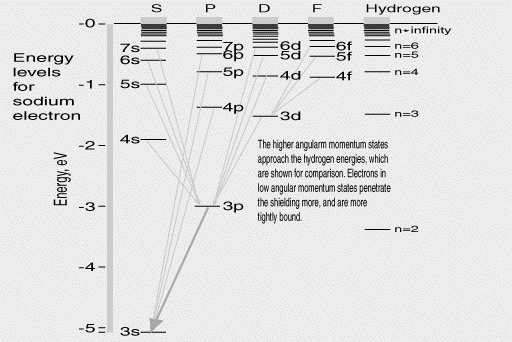
Siguiendo el éxito inicial de Bohr con su modelo del átomo, él intentó extenderlo más allá del hidrógeno, en un esfuerzo conjunto con un antiguo asociado, el teórico Alemán Arnold Sommerfeld. Ellos notaron que los átomos como el sodio eran algo parecido al hidrógeno, debido a que sus actividades químicas implicaban que solo un electrón estaba involucrado. Eso sugería que había solo un electrón activo orbitando lejos del núcleo, mientras que el resto de los electrones se conglomeraban más cerca del núcleo. El átomo de sodio por sí solo es eléctricamente neutro. Sea la carga del electrón designada por la letra e: si tiene 11 electrones con una carga total de –11e, como los datos lo sugerían, entonces su núcleo debe de balancear esto con una carga de +11e. Permita que 10 de los electrones se junten simétricamente alrededor del núcleo: entonces en la ubicación del solitario electrón exterior, su carga de –10e aproximadamente cancelará los efectos de 10e de la carga eléctrica del núcleo. Así, el electrón exterior por lo tanto, sensa una fuerza eléctrica de tan solo +e en la parte central, !lo mismo que el electrón en el átomo de hidrógeno¡ Como fue visto en la sección anterior, la cantidad que fue "cuantizada", que solo puede tomar múltiplos enteros de la constante h de Planck, parecía ser el momento angular, un vector asociado con la rotación alrededor de un eje, el cual definía la dirección de ese vector. Si un electrón tiene masa m, distancia r desde el eje de rotación, y su velocidad alrededor de él es v, entonces su momento angular es mrv. Los niveles de energía observados en el sodio tienen algunas similitudes con las del hidrógeno (mostradas en la esquina derecha del dibujo mostrado arriba, para comparación), aunque cada nivel está ahora dividido en una familia entera, el nivel n=4, por ejemplo, se divide en (4s, 4p, 4d,4f) [las letras tienen razones históricas, sin aplicación en este artículo]. Bohr y Sommerfeld pensaron que estas representaban órbitas con diferente elipcicidad, y por lo tanto, diferente momento angular. Supuestamente, esto cambia las energías de los niveles, aunque nadie puede calcular estos cambios. Las líneas que conectan los niveles de energía representan transiciones "permitidas", las cuales pueden emitir un fotón. Obviamente, solo algunas de las muchas posibles transiciones ocurren en la naturaleza. Magnetismo y el Giro del Electrón.El momento angular de una carga eléctrica rotativa está también asociado con el magnetismo: un electrón orbitando alrededor de un núcleo es equivalente (en promedio) a una corriente eléctrica fluyendo alrededor de su órbita, creando un campo magnético el cual a la distancia resembla a aquella de un pequeño imán en el centro, perpendicular al plano de la órbita. El momento angular del movimiento y la fuerza de ese plano son proporcionales. Si el átomo es colocado en un campo magnético, la interacción puede cambiar el momento angular, y por lo tanto, el nivel de energía, el cual puede subir o bajar, dependiendo de la dirección del "imán". El resultado sería la separación posterior de los niveles de energía, en varios subniveles ligeramente separados. Un "salto cuántico" de allí a un nivel inferior podría tener una de tales energías, con el resultado que, en lugar de una sola línea espectral de una frecuencia fija, ahora vemos un "múltiplo" de las muchas líneas ligeramente espaciadas. Esto fue observado en muchos átomos, aunque algo en la teoría parecía no concordar. Dos jóvenes físicos, George Uhlenbeck y Sam Goudsmit parecieron encontrar la razón en 1925: sugirieron que probablemente el electrón era por sí mismo una esfera giratoria, con un "giro" de momento angular y su propio magnetismo. Mediante la combinación del giro y del momento angular orbital de la misma manera que 2 vectores se combinan, e infiriendo algunas reglas cuánticas derivadas de la experimentación, esta separación de niveles se podía entender. Las reglas para encontrar qué niveles de energía se podían asociar y cuáles no, también fueron derivadas. El magnetismo del electrón girando resultó ser exactament el doble de lo que se esperaba, algo que luego fue explicado por Dirac, utilizando la relatividad. Todo esto era un esquema cualitativo, pero este patrón generalmente estaba de acuerdo con los datos. La tabla Periódica.En los elemento químicos con muchos electrones (como el sodio), a los electrones más externos se les podía hacer que brincaran de un nivel de energía al otro. A los electrones localizados a mayor profundidad, cercanos al núcleo, también se les esperaba que tuvieran niveles definidos de energía. El acomodar estos elementos en el orden del peso de sus átomos (obtenidos de su densidad como gases, o de otras maneras), logró dos características. Una, cada uno tenía un electrón más que el anterior (algo de lo cual los rayos X también daban evidencia), y dos, algunos patrones se parecían repetir, una y otra vez.Por ejemplo, el litio, sodio y potasio, así como el rubidio y el cesio, todos tenían comportamientos químicos similares, consistente con un solo electrón activo; el resto de los electrones dispuestos en un agrupamiento específico cerrado centrado en el núcleo. Tal patrón repetitivo (existen algunos) fue primero deducido en el siglo 19 por el químico Ruso Mendeleev ("Mendeleyev"), quien lo usó para predecir la existencia de algunos elementos todavía no descubiertos. Los electrones restantes en los apretados "núcleos" centrales del litio, sodio, potasio, etc, parecían representar arreglos bastante estables. Los elementos justo después de ellos en la lista, helio, neón y argón, eran "gases nobles", los cuales resistían cualquier combinación química, sugiriendo que todos sus electrones estaban en ese centro, en un enlace tan estable que ningún otro átomo se podía meter en él. ¿Qué determinaba el número de electrones en ese "centro" y por lo tanto, el número de elementos que se necesitaban pasar antes de que un nuevo "período" se forme? El litio era el tercer elemento, de manera que su centro tenía 2 electrones. El sodio era el onceavo, lo cual significaba 10 electrones en el centro, ocho más que el litio, probablemente como una "segunda capa" sobre la única del litio (y así sucesivamente). Por ese entonces, el arreglo de niveles de energía era conocido debido a los espectros, cada uno con un número "permitido" de estados de momento angular, y la idea era de que ellos formaban "caparazones" en los cuales los niveles de energía permitidos eran completamente llenados. El esquema en realidad funcionaba, pero solamente despues de que Pauli sugirió que cada nivel acomodaba exactamente dos electrones de diferentes giros. Entre los elementos más pesados, algunas veces los caparazones se llenaban en un orden diferente del esperado (algunos "exteriores" antes que unos "interiores"), pero de nuevo, el patrón parecía sensible. !Pero solamente el patrón¡ Se podían clasificar tal vez el orden de los niveles de energía, pero no predecir sus valores. Tampoco se pueden predecir la intensidad de las líneas de campo, si un átomo estaba en el nivel de energía "A", ¿Cuáles eran las probabilidades relativas de que brincara hacia "B" o hacia "C"? Como un ejemplo, ¿porqué eran las transiciones que involucraban a la doble línea amarilla del sodio tan prevalente que su luz dominaba todas las otras emisiones de ese átomo? Y si el átomo parecía un sistema planetario en miniatura, ¿porqué las frecuencias emitidas por los fotones parecían no estar relacionadas con las frecuencias orbitales calculadas para tales movimientos planetarios? ¿Y qué hay de las reglas arbitrarias respecto a los momentos angulares? La teoría de Bohr-Sommerfeld parecía dar suficientes pistas, pero no respuestas precisas. |